En genomgång av effektivitetstestning för desinfektionsmedel – hur relevant är våt kontakttid?

Introduktion
Användningen av desinfektionsmedel för att kontrollera mikrobiologisk kontaminering av en miljö är väletablerad och styrs av tillsynsorgan både i Europa och USA.
Förordningen om biocidprodukter 528/2012 [1] reglerar försäljning och användning av biocidprodukter i Europa. I USA registreras och regleras kemiska desinfektionsmedel av EPA (den amerikanska miljöskyddsmyndigheten), enligt den nationella lagen om insektsdödande, svampdödande och råttbekämpande medel (FIFRA) (40 CFR-delarna 150-189) [2]. Enligt FIFRA betraktas desinfektionsmedel som ”antimikrobiella bekämpningsmedel”.
Data som demonstrerar ett desinfektionsmedels påstådda effektivitet, vare sig det är bakteriedödande, svampdödande, spordödande eller virusdödande, är ett tydligt krav från BPR och EPA för att en desinfektionsmedelstillverkare ska registreras.
När det gäller slutanvändare av desinfektionsmedel inom läkemedelsbranschen kräver regelverken att även dessa demonstrerar desinfektionsmedlets effektivitet. Vägledning från FDA (US Food and Drug Administration) till läkemedelsbranschen anger att ”Lämpligheten, effektiviteten och begränsningarna hos desinfektionsmedel och -förfaranden måste granskas. Effektiviteten hos dessa desinfektionsmedel och förfaranden ska bedömas med avseende på deras förmåga att säkerställa att potentiella kontamineringar avlägsnas från ytor på ett adekvat sätt” [3]. I Europa finns liknande krav från Europeiska kommissionen, ”4.37 Desinfektionsprocessen måste valideras. Valideringsstudier måste påvisa desinfektionsmedlens lämplighet och effektivitet, specifikt för de sätt på vilka de används, och visa att brukslösningens nyttjandeperioder är lämpliga.” [4].
Metoder för att påvisa effektivitet
I Europa innehåller Europastandarden 14885:2018 [5] vägledning om vilka provningsmetoder som ska användas (enligt EN-standard) av desinfektionsmedlens tillverkare som evidens för påståenden om mikrobiocid verkan. I USA bekriver EPA:s riktlinjer för funktionstester OCSPP 810.2100 [6] de testmetoder (från AOAC) som ska användas av tillverkare av desinfektionsmedel för att påvisa riktigheten i påståenden om mikrobiocid verkan.
Testmetoderna kan delas in i två kategorier:
- Suspensionsprov
T.ex. EN 1276 Kemiska desinfektionsmedel och antiseptiska medel. Kvantitativt suspensionsprov för utvärdering av den baktericida verkan hos kemiska desinfektionsmedel och antiseptiska medel för användning i livsmedels-, industri-, hem- och institutionsmiljöer. Provningsmetod och krav (fas 2, steg 1).
EN 1650 Kemiska desinfektionsmedel och antiseptiska medel. Kvantitativt suspensionsprov för utvärdering av den fungicida verkan hos kemiska desinfektionsmedel och antiseptiska medel för användning i livsmedels-, industri-, hem- och institutionsmiljöer. Provningsmetod och krav (fas 2, steg 1).
AOAC officiell metod 955.15 prövning av desinfektionsmedels verkan mot Staphylococcus aureus. Använd spädningsmetod.
- Ytprov
T.ex. EN 13697 Kemiska desinfektions- och antiseptiska medel – Kvantitativ provning för utvärdering av baktericid och/eller fungicid effekt av kemiska desinfektionsmedel på ej porösa ytor inom livsmedels-, industri-, hushålls- och institutionsområden. Provningsmetod och krav utan mekanisk påverkan (fas 2, steg 2)
AOAC officiell metod 961.02 Bakteriedödande sprejprodukter som desinfektionsmedel.
De olika provningsmetoderna använder specifika startinokulat, organismer, log-reduktioner och kontakttider.
För att kunna göra påståenden om desinfektion inom Europa måste tillverkaren vanligtvis utföra EN-provningarna och EN-provningarnas nummer kan anges på produktetiketterna, tillsammans med de kontakttider som metoden anger som standardtider. De standardiserade provningsmetoderna används vanligtvis eftersom de är robusta, reproducerbara och väletablerade. Det kan också vara användbart för slutanvändarna att kunna hänvisa till resultaten från standardiserade provningsmetoder så att de kan jämföra produkter från olika tillverkare.
För slutanvändare av desinfektionsmedel kan det dock hända att de standardiserade provningsmetoderna inte korrekt speglar förhållandena i deras egen renrumsmiljö. Slutanvändare har ofta olika ytmaterial i sina renrum, olika mikroorganismer och olika miljöförhållanden (som låg luftfuktighet, korta torktider på grund av luftkonditionerings- och ventilationssystem).
USP (United States Pharmacopoeia), kapitel <1072> [7] innehåller ytterligare vägledning om effektivitetsprovningar för läkemedelsbranschen, och säger ”För att påvisa effektiviteten hos ett desinfektionsmedel i en tillverkningsmiljö för läkemedel kan det vara nödvändigt att utföra följande prov: (1) spädningstester (undersöka effektiviteten hos desinfektionsmedel vid olika koncentrationer och kontakttider och mot ett stort antal olika standardiserade testorganismer och miljömässiga isolat), (2) ytprovningsmetoder för desinfektionsmedel (användning av standardiserade testmikrorganismer och mikroorganismer som är vanligt förekommande i den aktuella miljön, applicera desinfektionsmedel på ytor i den valda brukskoncentrationen och under angiven kontakttid, samt bestämma log-reduktionen för de testade mikroorganismerna) och (3) en statistisk jämförelse mellan hur ofta mikroorganismer isoleras före respektive efter införande av ett nytt desinfektionsmedel.
Detta anses nödvändigt eftersom avgörande processteg, som desinficering av aseptiska produktionsområden, enligt krav i GMP-reglerna, behöver valideras och EPA:s registreringskrav inte beaktar hur desinfektionsmedel faktiskt används inom läkemedelsbranschen, bioteknikbranschen eller vid tillverkning av medicinsk utrustning.
När man följer USP:s rekommendationer är det relativt enkelt att använda olika mikroorganismer och testa ytor med de standardiserade provningsmetoderna. Dock kan det vara svårt att uppnå de kontakttider som anges i de standardiserade provningsmetoderna i de miljöförhållanden som gäller i ett renrum för läkemedelstillämpningar. Avdunstningshastigheten för ett desinfektionsmedel som applicerats på en yta i ett renrum med hög luftväxlingsgrad kan skilja sig betydligt från avdunstningshastigheten vid laboratorieförhållanden. Detta ger upphov till frågan om ytan måste vara synligt blöt med desinfektionsmedel under den angivna tiden för att det ska fungera effektivt, och därmed precis vad som menas med kontakttid.
Definitioner av kontakttid
För att ta reda på om det är ett lagstadgat krav för läkemedelsbranschen att ytor ska vara synligt blöta under hela kontakttiden (härefter kallad ”våt kontakttid”) gjordes en genomgång av regelverken.
Varken USA [3],[8], EU:s goda tillverkningssed [4] eller samarbetssystemet för läkemedelsinspektion [9] definierar ”kontakttid”. Europeiska farmakopén (EP) ger inte någon vägledning om effektivitetsprovning av desinfektionsmedel. Däremot nämner kapitel 1072 [7] av USP begreppet ”kontakttid” regelbundet, men beskriver inte vad som menas med detta i kapitlets definitionsdel. ISO-standarden för renrum (ISO 14644 del 5 [10]) innehåller inte heller någon definition.
Eftersom regelverken för läkemedelsbranschen inte tillhandahåller någon tydlig definition genomfördes en bredare sökning bland övrig gällande lagstiftning och vedertagna branschrekommendationer för segmentet.
Royal Pharmaceutical Society/NHS Pharmaceutical Quality Assurance Committee tillhandahåller vägledning om applicering av desinfektionsmedel, där man anger att ”Ansamlingar av stora mängder rengörings- och desinfektionsmedel bör undvikas. Ytor ska helst ha torkat inom 1 timme efter applicering. Dock måste tillräckligt mycket av produkten finnas kvar för att uppnå den verkan som krävs under hela den rekommenderade kontakttiden, dvs desinfektionsmedel får inte appliceras i för tunna lager” [11]. Av detta uttalande kan man dra slutsatsen att våt kontakttid krävs för att uppnå önskad verkan.
Varken EN- eller AOAC-metoderna anger någon ”våt kontakttid”. Vid suspensionsprover används ”våt kontakttid” alltid eftersom provningen innebär att desinfektionsmedlet läggs till i en suspension av organismer och lämnas i lösningen under den kontakttid som krävs. Ett produktneutraliserande medel läggs till i slutet av denna kontakttid.
Det är inte lika tydligt för ytprövningar, eftersom den mängd desinfektionsmedel som anges i standarden appliceras med pipett på ytan, utan att medlet sprids ut. Eftersom de volymer som appliceras med pipetten är väldigt små och de flesta desinfektionsmedel som testas har en relativt hög ytspänning, är det troligt att en våt kontakttid kommer att uppnås under laboratorieförhållanden.
EN-ytprovningsmetoden med mekanisk påverkan, EN 16615 [12], är den provningsmetod som ligger närmast verklig användning av desinfektionsmedel, eftersom den inkluderar åtgärden att stryka ut desinfektionsmedlet över en yta. Avsnittet om försöksbetingelser innehåller följande information om kontakttiden: ”Kontakttiden för desinfektionsmedel för ytor har valts baserat på produktens praktiska villkor. Tillverkaren är ansvarig för den rekommenderade kontakttiden vid användning av produkten.” Ordvalet ”produktens praktiska villkor” kan tolkas som att de avser volymer som appliceras via moppning eller torkning, och avdunstningshastigheter, t.ex. jämförelse mellan en alkohol och en kvartär ammoniumförening, men återigen är detta ingen entydig definition.
En teknisk monograf från Pharmaceutical and Healthcare Sciences Society (PHSS), 20, ger följande information i avsnitt 3.3.4 ”Kupongerna exponeras för desinfektionsmedlet under den angivna våta/bibehållna kontakttiden” [13]. Detta anger tydligt att kontakttiden är våt.
Riktlinje [14] från CDC (US Center for Disease Control and Prevention) innehåller följande definition av kontakttid i sin ordlista: ”Tiden som ett desinfektionsmedel är i direkt kontakt med ytan eller föremålet som ska desinficeras. För ytdesinficering omfattar detta tiden från den tidpunkt då medlet applicerades på ytan tills det har torkat helt.” Den här definitionen hänvisar också tydligt till våt kontakttid.
Provningsriktlinjerna för produkters prestanda, OCSPP 810.2000 [15], säger följande om kontakttid: ”Den kontakttid som används vid effektivitetsprövning ska vara densamma eller kortare än den kontakttid som anges på produktetiketten. Om en kontakttid som ligger utanför det intervall som anges i provningsmetoden eller riktlinjen väljs rekommenderas att man rådfrågar organisationen innan provning utförs och det är möjligt att det standardiserade tillvägagångssättet behöver modifieras. I de flesta fall begränsas möjligheten att förlänga exponeringstiden av praktiska överväganden som rör användningsmönster (t.ex. en exponeringsperiod på mer än 10 minuter för en produkt som troligen kommer att avdunsta från ytan inom 10 minuter). Alla metodmodifikationer måste identifieras tydligt och motiveras i provningsprotokollet. För flytande produkter och sprayprodukter som innehåller flyktiga aktiva ingredienser och där produkten appliceras på en hård, icke-porös yta, kan den maximala kontakttiden bestämmas via visuell inspektion av avdunstningen under den föreslagna kontaktperioden.” Återigen visar det här uttalandet tydligt att förväntningen är att kontakttiden är våt.
En teknisk rapport, 70 [16], från PDA ger följande definition i sin ordlista: ”Den kortaste tidsperiod som ett steriliserande, desinficerande eller spordödande medel måste befinna sig i komplett (våt) kontakt med den yta som behandlas för att vara effektivt”. Definitionen anger tydligt att det handlar om våt kontakttid.
Pharmigs guide för användning av desinfektionsmedel [17] innehåller följande text: ”Snabbare avdunstning av desinfektionsmedel kan uppstå på varma ytor eller i fall där den behandlade ytan utsätts för förhållanden där låg luftfuktighet eller stort luftflöde råder, vilket ibland är fallet i renrumsverksamheter.” Av detta uttalande kan man dra slutsatsen att våt kontakttid krävs för att uppnå önskad verkan.
Ovanstående genomgång av respekterade publikationer inom läkemedelsbranschen tydliggör kravet att kontakttiden är våt.
Det är inte omöjligt att desinfektionsmedlet förblir verksamt även efter det att ytan är synligt torr, eftersom verkan sker på cellnivå. Det första steget i avdödande av mikrober är att cellen tar upp den aktiva ingrediensen i desinfektionsmedlet. Man kan därmed hävda att det finns två ”tider” som har betydelse vid desinficering (figur 1).
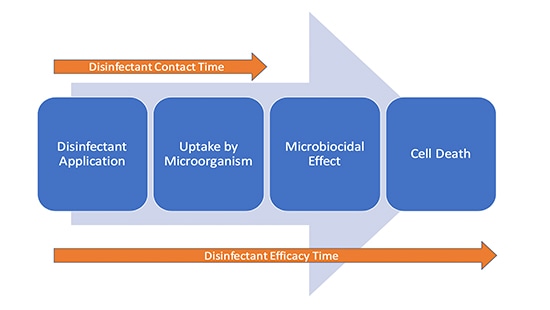
Slutsats
För att påvisa effektivitet måste en desinfektionsmedelstillverkare utföra standardiserade provningar under reproducerbara förhållanden, baserat på vilka en kontakttid definieras. Den här kontakttiden kan vara användbar när slutanvändaren väljer lämpligt desinfektionsmedel.
Slutanvändaren måste också validera desinfektionsmedlets effektivitet, vid förhållanden som speglar användningen på deras anläggning och inkluderar definiering av en kontakttid som ska användas i praktiken.
De flesta organisationer som ger rekommendationer till läkemedelsbranschen definierar kontakttid som våt kontakttid.
Bara ett fåtal publicerade studier har undersökt desinfektionsmedlets verkan på ytor som är synligt torra. Detta är också omöjligt att mäta i praktiken, eftersom användaren inte kan använda observerad celldöd som effektmått.
För att göra det lättare för slutanvändare att utföra provningar som speglar förhållandena på deras anläggning uppmuntras de att mäta den tid det tar för desinfektionsmedel att avdunsta när de appliceras med rutinmässiga metoder (torkning/moppning) och använda denna kontakttid vid laboratoriestudier.
Referenser:
- Europaparlamentets och rådets förordning (EU) nr 528/2012 från den 22 maj 2012 om tillhandahållande på marknaden och användning av biocidprodukter
- Title 40 of the Code of Federal Regulations (40 CFR) Subchapter E Pesticide Programs Parts 150-189
- FDA Guidance for Industry - Sterile Drug Products Produced by Aseptic Processing, Current Good Manufacturing Practice (2004)
- EudraLex volym 4 EU:s riktlinjer för god tillverkningssed för läkemedelsprodukter för humant och veterinärt bruk, bilaga 1 tillverkning av sterila läkemedelsprodukter (utkast v.12, utgiven i februari 2020)
- EN 14885:2018 Kemiska desinfektionsmedel och antiseptiska medel. Applicering av Europastandarden för kemiska desinfektionsmedel och antiseptiska medel
- EPA Product Performance Test Guideline, OCSPP 810.2100, Sterilants, Sporicides, and Decontaminants, Guidance for Efficacy Testing, [EPA 712-C-17-003]
- United States Pharmacopoeia (USP) chapter 1072 Disinfectants and Antiseptics
- The Code of Federal Regulations CFR Title 21 - Food and Drugs: Parts 1 to 1499
- PICS GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS ANNEXES PE 009-14
- ISO 14644 del 5 Renrum och tillhörande renhetskontrollerade miljöer – Del 5: drift, 2004
- Royal Pharmaceutical Society. Quality Assurance of Aseptic Preparation Services: Standards. Part A 5th Edition 2016
- EN 16615 Kemiska desinfektionsmedel och antiseptiska medel – Kvantitativ provning för utvärdering av baktericid och jästicid aktivitet vid mekanisk bearbetning av icke-porösa ytor med fuktad torkduk inom hälso- och sjukvården (4-rutors-test) – Provningsmetod och krav (fas 2, steg 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 Bio-Contamination characterisation, control, monitoring and deviation management in controlled / GMP classified areas
- Center for Disease Control and Prevention (CDC) Guideline for Disinfection and Sterilization in Healthcare Facilities (2008)
- Product Performance Test Guideline, OCSPP 810.2000, General Considerations for Testing Public Health Antimicrobial Pesticides, Guidance for Efficacy Testing, [EPA 712-C-17-002]
- Parenteral Drug Association (PDA) Technical Report No. 70. The Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities (2015).
- Pharmig Guide to Disinfectants and their use in the Pharmaceutical Industry (2017)
- West AM, Teska, PJ, Oliver HF; There is no additional bactericidal efficacy of Environmental Protection Agency registered disinfectant towelettes after surface drying or beyond label contact time. Am J Infect Control 2019; 47: 27-32



